আসসালামু আলাইকুম । আশা করি সকলে ভালো আছেন । আমিও আলহামদুলিল্লাহ আপনাদের দোয়ায় অনেক ভালো আছি । যাই হোক আমি বেশি কথা বাড়াতে চাই না সরাসরি পোস্টের কথাতে চলে আসতে চায় ।
অনেকেই হয়তো পোস্টের টপিক দেখেই বুঝে ফেলেছেন যে আজ আমি কোন বিষয় নিয়ে লিখতে যাচ্ছি । আজ আমি আপনাদের সাথে বিজ্ঞানের একটি বিষয় [মৌলের ইলেক্ট্রন বিন্যাস] নিয়ে আলোচনা করতে যাচ্ছি । আশা করি সকলে আমার আজকের পোস্ট পড়বেন । ভালো লাগলে লাইক এবং কমেন্ট করবেন ।
মৌলের ইলেক্ট্রন বিন্যাস শেখার এটি ২য় পব । ১ম পবে অরবিটালগুলো সাজানো শিখিয়েছিলাম । এই পবে মৌলের ইলেক্ট্রন বিন্যাস করা শিখব । তবে তার আগে যেটা শিখব সেটা হলো অরবিটালগুলোর ইলেক্ট্রনের ধারণ ক্ষমতা ।
SPDF অরবিটালগুলোর একেকটি একেক রকম । এরা কে কতটি ইলেক্ট্রন নিতে পারবে তা নিচের ছবিতে দেখানো হলো ।

s দুটি, pছয়টি, d দশটি এবং f ১৪টি ইলেক্ট্রন নিতে পারবে । মনে রাখার কৌশল হিসেবে প্রত্যেক বিজোড় সংখ্যার ২ গুণ করে দেখানো হয়েছে ।
এখন মৌলের ইলেক্ট্রন বিন্যাস শুরু করে দিন । গত পবে বলেছিলাম মৌলের ইলেক্ট্রন বিন্যাস করতে পারমাণবিক সংখ্যার প্রয়োজন হয় । পারমাণবিক সংখ্যা অনুযায়ী এবং অরবিটালের ধারণ ক্ষমতা অনুযায়ী অরবিটালে ইলেক্ট্রন দিতে হবে । চলুন কিছু নমুনা দেখে আসি ।
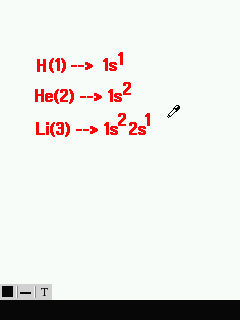
আমারা প্রথমে হাইড্রোজেনের ইলেক্ট্রন বিন্যাস দিয়েই দেখি । এর প্রতীক H এবং পারমাণবিক সংখ্যা ১ ।
H(1)–> 1s1
এভাবে হিলিয়াম(He) ও লিথিয়াম(Li) এর ইলেক্ট্রন বিন্যাস নিচের ছবিতে দেখানো হয়েছে ।
আবার, সোডিয়াম (Na) এর ইলেক্ট্রন বিন্যাস নিচে দেখানো হয়েছে ।
Na(11)–>1s2 2s2 2p6 3s1

এখানে 1s এ ২টি ইলেক্ট্রন দেওয়া হয়েছে । কারণ s সবোচ্চ ২টি ইলেক্ট্রন নিতে পারে । 2s এর ক্ষেত্রেও তাই । 2p তে ৬টি দেওয়া হয়েছে । কারণ p ৬টি ইলেক্ট্রন নিতে পারে । 3s এ ১টি দেওয়া হয়েছে । ২টি দেওয়া যেত তবে সোডিয়ামের ১১টি পূণ হওয়ায় আর দেওয়া যাবে না ।
॥ আজ এতটুকুই ছিল । আরও কিছু ব্যাতীক্রম ধমী মৌলের ইলেক্ট্রন বিন্যাস নিয়ে পরবতী পাঠে আলোচনা করা হবে ॥
আপনারা চাইলে এগুলো অনুশীলন করতে পারেন ।
Mg(12),Cl(17),Al(13)
কোন প্রশ্ন থাকে জিজ্ঞাসা করতে পারেন ।

